
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
El kit de transporte de virus de BABIO obtiene la autorización 510(k) de la FDA
2025-10-30
El kit de transporte de virus de BABIO obtiene la autorización 510(k) de la FDA
Jinán, China – octubre de 2025— BABIO Biotechnology, un reconocido fabricante chino de reactivos de diagnóstico médico, anuncia con orgullo que suKit de transporte de virus (no inactivante)ha recibidoAutorización FDA 510(k) (K250205), validando oficialmente su cumplimiento de los estándares regulatorios de EE. UU.
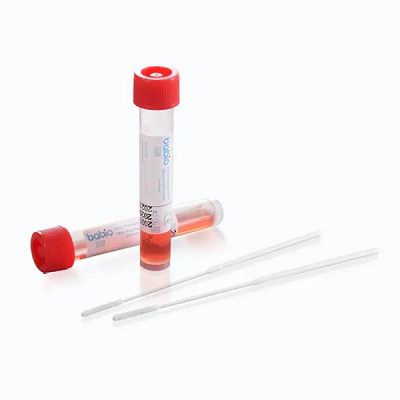
Este hito refuerza el liderazgo global de BABIO en soluciones de transporte de muestras clínicas. El kit está diseñado para la recolección segura y estable de muestras virales, y admite aplicaciones posteriores comoRT-PCR, cultura viral, ydiagnóstico molecular. Cuenta con:
-
✅ Estabilidad de la temperatura ambiente
-
✅ Solución de Hank mejorada con antibióticos
-
✅ Tubos cónicos libres de DNasa/RNasa
-
✅ Hisopos flocados seguros con diseño de punto de interrupción
Disponible en múltiples volúmenes de llenado (1 ml a 6 ml) y tamaños de paquete (20 a 500 tubos), el kit es ideal para hospitales, laboratorios e instituciones de salud pública de todo el mundo.
con unCapacidad de producción diaria de 100.000 unidades., BABIO garantiza un suministro constante y precios competitivos. Confiado en elEstados Unidos, Alemaniay más allá, BABIO continúa brindando innovación y confiabilidad en sistemas de transporte de virus. Obtenga más información en https://www.babiocorp.com.
#VirusTransportKit #FDA510k #BABIO #ClinicalDiagnostics #VTM #RT-PCR #GlobalHealthcare #MedicalDevices #SpecimenCollection


