
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
BABIO obtiene la autorización 510(k) de la FDA de EE. UU. para su kit de transporte de virus (no inactivante)
2025-10-10
BABIO obtiene la autorización 510(k) de la FDA de EE. UU. para su kit de transporte de virus (no inactivante)
Jinán, China – octubre de 2025 – Jinan Babio Biotecnología Co., Ltd. (BABIO)anuncia con orgullo que suKit de transporte de virus Babio® (no inactivante)ha recibido oficialmenteAutorización FDA 510(k) (K250205). Esta certificación marca un hito importante para BABIO, reafirmando su compromiso con la calidad, la seguridad y la innovación global en el diagnóstico clínico y los sistemas de transporte microbiológico.
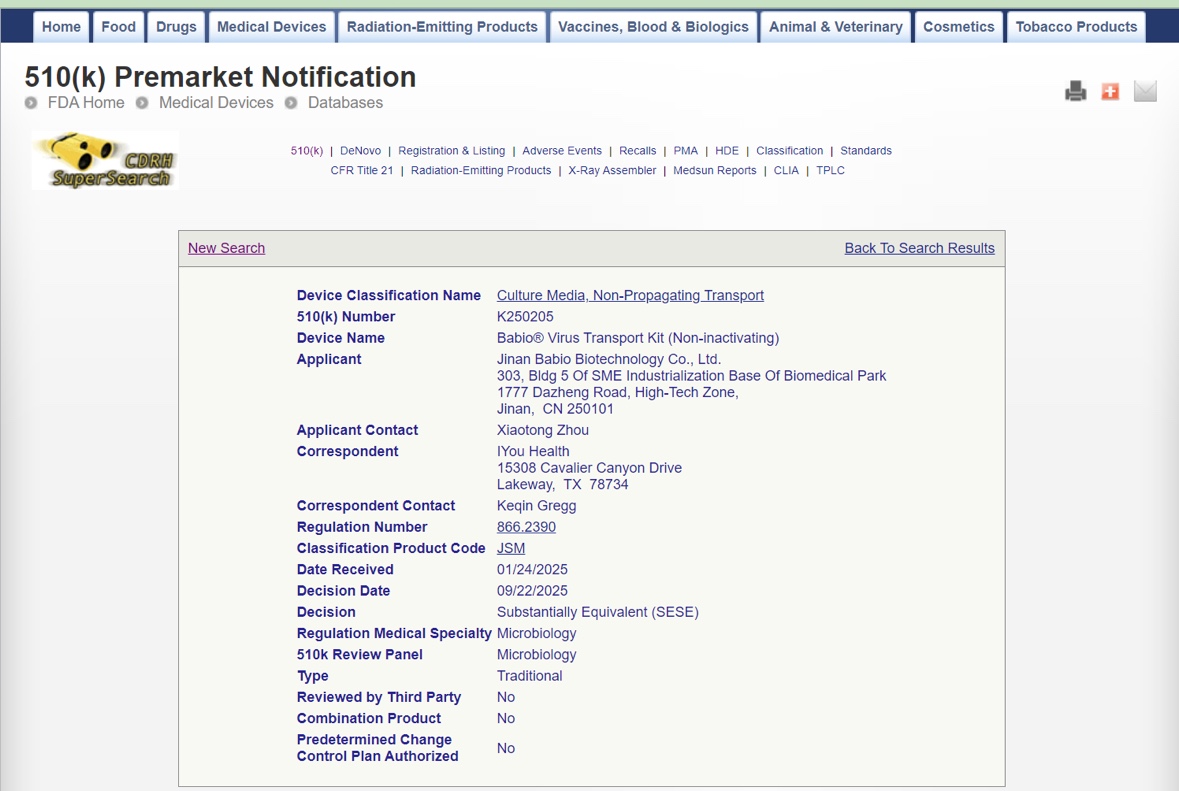
La autorización 510(k) de la FDA autoriza el kit de transporte de virus Babio® comosustancialmente equivalentea dispositivos comercializados legalmente en los Estados Unidos, validando su cumplimiento con los estándares regulatorios de los EE. UU. para dispositivos médicos. Este logro demuestra las sólidas capacidades de I+D y la excelencia en fabricación de BABIO, fortaleciendo aún más su competitividad global en elmercado de transporte de virus y recolección de muestras.
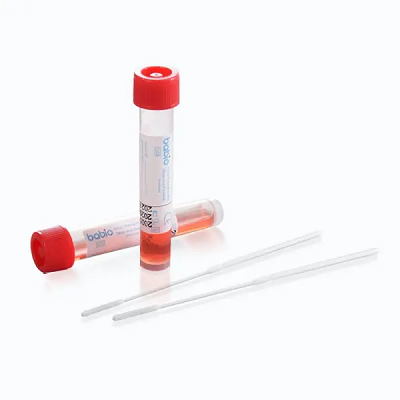
ElKit de transporte de virus Babio® (no inactivante)está diseñado para la recolección y transporte seguro de muestras clínicas que contienen virus. Mantiene la integridad de la muestra para pruebas posteriores, comoRT-PCR, cultura viral, ydiagnóstico molecular, lo que lo hace adecuado para hospitales, laboratorios e instituciones de salud pública en todo el mundo.

BABIO, afabricante chino líderde reactivos de diagnóstico, medios de transporte y medios de cultivo, continúa ampliando su presencia enEuropa, Estados Unidos, África y el Sudeste Asiático, brindando soluciones confiables que cumplen con los estándares internacionales.
Para obtener más información sobre los productos certificados y las innovaciones de diagnóstico de BABIO, visite: https://www.babiocorp.com
#BABIO #FDA510k #VirusTransportKit #MedicalDevices #Diagnostics #BiotechChina #GlobalHealthcare #ClinicalDiagnostics #Microbiology


